1 Ozon en de ozonlaag
Ozon is een giftige, sterk reactieve verbinding van drie
zuurstofatomen. Het woord 'ozon' komt van het Griekse 'ozein', dat
ruiken betekent. Klinkt logisch want het gas heeft een zeer typische
geur. Bij standaardtemperatuur en -druk vertoont gas een blauwe kleur.
Wanneer de temperatuur onder -122°C daalt, condenseert ozon tot
een vloeistof, dan is het een donkerblauwe stof. Als de
temperatuur onder het smeltpunt van -193°C daalt, wordt ozon een
donkerblauwe vaste stof.
Ozon is een sterk oxiderend
gas dat tegenwoordig vaak chloor vervangt als bleekmiddel en
ontsmettingsmiddel. Een voordeel van ozon is dat het in tegenstelling
tot chloor geen smaak achterlaat. Het wordt gebruikt in de
luchtzuivering, voor het desinfecteren van water bij
drinkwaterbereiding, voor het ontsmetten van verpakkingen vooral
wanneer het met voedsel te maken heeft. In de atmosfeer vervult ozon
eenzelfde soort zuiverende werking.
Dagelijks wordt in de stratosfeer ongeveer 300 miljoen ton ozon geproduceerd.
Er bestaan twee soorten ozon: het hoge atmosferische ozon en het troposferische ozon aan het aardoppervlak.
1.1 Vorming van ozon
Ozon kan op natuurlijke wijze ontstaan uit zuurstof (O2). De vorming van ozon gebeurt in twee stappen.
Eerst wordt zuurstof in de
stratosfeer door ultraviolette (UV) zonnestraling gesplitst in 2
uiterst reactieve zuurstofatomen. Indien dit zuurstofatoom zich in een
tweede stap verbindt met een ander zuurstofmolecule krijgt men ozon.
O2 + UV-straling --> O + O (fotolyse van zuurstof)
Een zo ontstaan zuurstofatoom kan met een zuurstofmolecule ozon vormen:
O + O2 --> O3 (combinatie tot ozon)
1.2 Afbraak van ozon
Ozon kan op twee verschillende manieren natuurlijk afgebroken worden.
Enerzijds kan UV-straling van de zon de ozonmolecule opnieuw splitsten
in een zuurstofatoom en een zuurstofmolecule . Anderzijds kan een
zuurstofatoom met een ozonmolecule botsen en zo 2 zuurstofmoleculen
laten ontstaan.
O3 + UV-straling --> O2 + O* (fotolyse van ozon, O* heeft vaak extra energie over)
O* is een zuurstofradicaal, dat wil zeggen een zuurstofatoom met een vrij, ongepaard elektron.
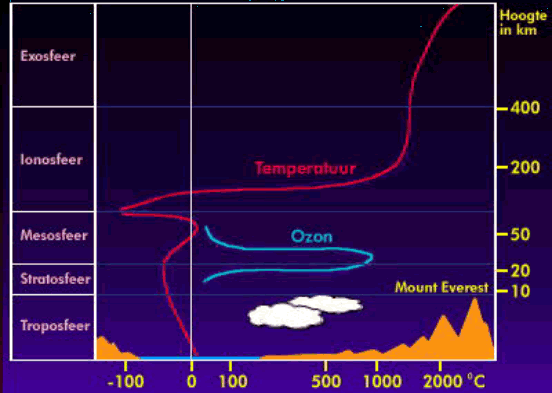
1.3 Stratosferische en troposferische ozon.
Ozon bevindt zich voornamelijk in twee lagen van onze atmosfeer: in de troposfeer en in de stratosfeer.
Ozon in de stratosfeer
Ongeveer 90% van de totale
hoeveelheid ozon die zich in de aardse atmosfeer bevat, zit in de
stratosfeer. De stratosfeer is een laag van de atmosfeer die zich boven
de troposfeer bevindt, op een hoogte van 10 à 15 km boven het
aardoppervlak. Deze concentratie van ozon is stratosferische ozon ook
wel bekend als de ozonlaag.
De ozonlaag is van zeer groot
belang voor de aarde. Ze absorbeert een groot deel van de UV-straling
van de zon, zodat slechts een klein deel van deze schadelijke straling
het aardoppervlak bereikt. UV-stralen zijn schadelijke stralen van de
zon. Er zijn twee soorten UV-stralen: UVa en UVb. UVa-stralen zijn de
minst schadelijke stralen, in tegenstelling tot UVb-stralen die veel
schadelijker zijn. De ozonlaag houdt vooral een groot deel van de UVb
stralen tegen en laat de UVa stralen door. Ook in de structuur van onze
atmosfeer speelt de ozonlaag een grote rol. We zien namelijk dat de
temperatuur van de troposfeer daalt wanneer de hoogte toeneemt. In het
onderste gedeelte van de stratosfeer (daar waar de ozonlaag zich
bevindt) blijft de temperatuur ongeveer gelijk. Eenmaal boven de
ozonlaag zien we dat de temperatuur weer toeneemt. Dit komt omdat de
opname van UV-straling door ozon warmte afgeeft en omdat een deel van
de straling van de zon wordt weerkaatst op de ozonlaag.
Stratosferische ozon is dus
goed, omdat het een groot deel van de schadelijke UV-straling van de
zon tegenhoudt en omdat het mee instaat voor de temperatuurstructuur
van de aardse atmosfeer.
Ozon in de troposfeer
De overige 10% van de ozon
bevindt zich in de troposfeer. De troposfeer is de atmosferische laag
waar wij in leven. Ze bestaat hoofdzakelijk uit de gassen stikstof en
zuurstof. In deze troposfeer bevinden zich allerlei luchtvervuilende
stoffen als stikstofoxiden, vluchtige koolwaterstoffen en koolmonoxide
afkomstig van uitlaatgassen van auto's, de chemische industrie,
elektriciteitscentrales, enzovoort. Door inwerking van zonlicht op die
stoffen wordt ozon gevormd, een giftige stof die schadelijk is voor
mens en dier. Deze troposferische ozon wordt een secundaire vorm van
vervuiling genoemd omdat ze pas ontstaat bij inwerking van het zonlicht
op de reeds aanwezige lucht vervuiling. Men spreekt in dit verband ook
al eens van foto-smog. De vorming van ozon in de troposfeer is het
grootst in de zomer. De luchttemperatuur en de intensiteit van de
zonnestraling zijn dan immers het hoogst waardoor de chemische reactie
het vlotst verloopt.